Твоё здоровье
ЗАОЧНАЯ ШКОЛА ПАЦИЕНТА
В. Е. Поляков
БОЛЕЗНИ КРОВИ И ОРГАНОВ КРОВЕТВОРЕНИЯ
Судя по письмам в редакцию, наши читатели все чаще сталкиваются с проблемами заболеваний крови, будучи родителями, близкими, родственниками больных, либо собственно больными.
Конечно, болезни крови и органов кроветворения существовали всегда. Однако в наше время ухудшающиеся условия жизнедеятельности (неполноценное питание, загрязнение воздуха и воды, радиация и др.) вносят негативные коррективы в заболеваемость населения (подверженность болезни, ее протекание, исход).
Заболевания крови, столь нередкие в наше время, у людей, встречающихся с ними, часто вызывают самые невероятные опасения, страхи и, как правило, полное непонимание того, что происходит с организмом при тех или иных болезнях крови, каковы шансы на излечение.
Что уж говорить о вопросах профилактики, предупреждения болезней органов кроветворения — люди подчас вообще не отдают себэ отчета е том, что такое кровь и откуда она берется, что дает организму, в чем ее жизнедеятельная сила.
Вот почему, идя навстречу пожеланиям читателей, мы посвящаем этой теме рубрику «Заочная школа пациента» в настоящем и двух-трех последующих выпусках «Твоё здоровье».
ЧАСТЬ I
Прежде чем обратиться к болезням крови как таковым и к вопросам их профилактики и излечения, попытаемся разобраться с тем, как возникает кроветворение в организме и как оно происходит – вначале внутриутробно, а затем с момента рождения – у детей и далее каким становится у взрослых.
КАК ВОЗНИКАЕТ У ЧЕЛОВЕКА КРОВЬ
Различаю; два принципиально разных периода жизни ребенка: внутриутробный и внеутробный (после рождения). И соответственно свои особенности имеют внутриутробное кроветворение эмбриона (и плода] и внеутребное кроветворение.
Известно, что внутриутробный период длится от момента оплодотворения яйцеклетки до рождения. Это продолжается около 230 дней, т. е. 9 календарных месяцев (точнее, 10 лунных месяцев — по 4 недели в каждом).
Внутриутробный период включает в себя эмбриональную фазу развития (первые 2 месяца) и следующую за ним фазу развития плода (плацентарную, или фетальную).
Так вот, процесс кроветворения начинается уже в конце 2-й — начале 3-й недели с момента оплодотворения. Рассмотрим три основные стадии кроветворения во внутриутробном периоде.
Знание об организме поможет нам уяснить, как обеспечивается здоровье человека и почему могут возникать те или иные заболевания.
I стадия — мезодермальная
Начавшись на рубеже 2-3 недель внутриутробного развития, мезодермальная стадия кроветворения заканчивается на 3-м месяце жизни плода.
Особенностью ее является то, что кроветворение происходит вне эмбриона — в кровяных островках желточного мешка, почему эту стадию и называют еще стадией внеэмбрионального кроветворения, или стадией ангиобласта, подчеркивая тем самым внутрисосудистый характер гемопоэза.
Как это происходит! Зачатки кровяной ткани, содержащие первичные кроветворные клетки, обособляются во внеэмбриональной мезенхиме, т. е. в совокупности отдельных клеток, расположенных в первичной полости тела между зародышевыми листками.
Уровень кроветворения других ростков совсем незначительный, в основном первичный эритропоэз происходит, как уже говорилось, в желточном мешке эмбриона.
Эти примитивные, еще содержащие ядро, первичные красные кровяные клетки называются мегалобластами, потому что, отличаясь большими размерами (метало), являются исходными ростковыми клеткам» (бласты).
II стадия — печеночно-селезеночная
Со временем клетки в неэмбриональной мезенхимы желточного мешка перемещаются внутрь тканей эмбриона и из них образуются внутренние органы.
Уже ка 3-4-й неделе у эмбриона закладывается в качества самостоятельного органа печень, но только с 5-й недели она становится центром кроветворения.
В печени кроветворение происходит вне сосудов — в островках мезенхимальных клеток, расположенных между печеночными клетками.
Сначала в печени эмбриона образуются первичные мегабласты, а с 6-й недели развития первичные мегабласты замещаются в печени вторичными эритробластами, все более приближающимися по размерам и форме к эритроцитам, кроме которых в печени образуются гранулоциты и мегакариоциты.
На 9-й неделе внутриутробного развития впервые в печени появляются В-лимфоциты. К 11-й неделе на их поверхности удается различить разные классы иммуноглобулинов.
С 5-го месяца интенсивность кроветворения а печени резко снижается, но небольшие островки печеночного кроветворения сохраняются вплоть до рождения ребенка.
Вилочковая, или зобная, железа (тимус) закладывается у эмбриона на 6-й неделе внутриутробного развития, а на 9-й и 10-й неделе в тимусе появляются первые лимфоидные клетки.
Эти клетки развиваются из переселившихся своих предшественников из желточного мешка и печени эмбриона.
Процесс клеточной дифференцировки приводит к развитию в тимусе и под его влиянием так называемых иммунокомпетентных Т-лимфоцитов, которые быстро накапливаются в вилочковой железе в большом количестве и интенсивно расселяются по всем кроветворным органам: печени, селезенке, костному мозгу, лимфатическим узлам.
Лимфоциты, находящиеся под влиянием тимуса (Т-лимфоциты), участвуют затем в иммунных реакциях клеточного типа.
Что касается закладки селезенки, это происходит у эмбриона в конце 6-й недели, а с 12-й недели в селезенке плода развиваются все клетки крови: вне сосудов — из стволовых клеток, попавших сюда, как полагают, из печени.
На первом этапе осуществляются эритроцитопоэз, гранулоцитопоэз и мегакариоцитопоэз, а с 20-й недели процесс этот сменяется интенсивным лимфопоэзом.
Полагают, что селезенку заселяют лимфоциты (но не стволовые клетки!) из тимуса, уже «обученные» клеточным иммунным реакциям.
В селезенке развивается вторичная лимфоидная ткань, в лимфоцитах которой с 20-й недели обнаруживают внутриклеточные иммуноглобулины.
Так как с 5-й по 16-ю недели процесс кроветворения наиболее интенсивно протекает в печени, а с 17-й — в селезенке, данную стадию кроветворения называют еще печеночно-селезеночной.
III стадия — костномозговая
С 13-14-й недели первые гемопоэтические очаги появляются в костном мозге. Вначале наиболее активными центрами кроветворения становятся трубчатые кости, затем ребра, грудина, тела позвонков. В костном мозге происходит образование клеток всех ростков кроветворения.
К концу 24-й недели жизни плода на долю костного мозга приходится уже около половины продукции эритроцитов, а к моменту рождения ребенка костный мозг в состоянии обеспечить уже весь эритроцитопоэз. То же откосится к гемопоэзу других ростков кроветворения.
Так как с 13-й недели жизни плода основным органом кроветворения становится костный мозг, эту стадию называют стадией костномозгового кроветворения.
Важно то обстоятельство, что в растущем и развивающемся организме нет и не может быть строгих временных границ смены одной стадии кроветворения другой, так как ослабление гемопоэтической активности в одном месте тут же сменяется ее усилением в другом месте.
В кроветворении также участвуют лимфатические узлы, которые впервые обнаруживаются на 13—14-й неделе развития плода. Процессы образования нейтрофилов в лимфатических узлах с 16—17-й недели быстро сменяются образованием лимфоцитов.
Лимфатические узлы заселяют «обученные» иммунным реакциям лимфоциты из тимуса. В лимфатических узлах развивается вторичная лимфоидная ткань. Образование лимфоцитов в лимфатических узлах начинается с 16—17-й недели развития плода.
С последовательностью включения различных органов в кроветворение плода можно ознакомиться в приведенной таблице.
Развитие гемопоэтической системы человека
| Органы кроветворения | Периоды внутриутробного развития, недели |
|---|---|
| Начало кроветворения внутри сосудов желточного мешка |
3—4 |
| Закладка печени |
3—4 |
| Начало кроветворения в печени |
5 |
| Закладка тимуса |
6 |
| Закладка селезенки |
6 |
| Появление первичных лимфоидных клеток в тимусе |
9—10 |
| Начало эритропоэза в селезенке |
12 |
| Начало гемопоэза в костном мозге |
13—14 |
| Появление первых лимфатических узлов |
13—14 |
| Начало лимфопоэза в периферических лимфатических узлах |
16—17 |
| Начало лимфопоэза в селезенке |
20 |
КАК СКЛАДЫВАЕТСЯ КРОВЕТВОРЕНИЕ ПОСЛЕ РОЖДЕНИЯ
После рождения в процессе роста и развития ребенка различают несколько возрастных периодов:
период новорожденности — от момента рождения до 3—4 недель;
грудной или младший ясельный возраст — до 1 года;
преддошкольный или старший ясельный возраст — от 1 года до 3 лет;
дошкольный или детсадозский возраст — от 3 до 7 лет;
младший школьный еозраст или период отрочества — от 7 до 12 лет;
старший школьный возраст или период полового созревания — от 12 до 16—13 лет.
Присущие детскому возрасту физиологические особенности находят свое проявление во всей системе кроветворения ребенка и отражаются на количественном и качественном составе крови.
У ребенка раннего возраста (до 3 лет) кроветворение происходит во всех костях, но с 4—5 лет красный костный мозг в некоторых костях замещается желтым (жировым).
К 12—15 годам в процессе кроветворения участвует лишь красный костный мозг плоских костей (ребер, грудины), позвонков и эпифизов (суставных концов) длинных трубчатых костей.
К моменту рождения у ребенка хорошо развита и богата лимфоцитами вилочковая железа.
Селезенка и лимфатические узлы продолжают формироваться до 10—12 лет. За этот период в них возрастает количество лимфоидной ткани, совершенствуется их строение.
Первые признаки снижения роли селезенки и лимфатических узлов в кроветворении появляются после 20—30 лет, а вилочковой железы еще ранее — с 10—15 лет. При этом в лимфатических узлах и вилочковой железе разрастается соединительная ткань, увеличивается количество жировых клеток вплоть до почти полного замещения ими ткани этих органов, что приводит к постепенному уменьшению количества лимфоцитов.
Во всех органах кроветворения имеются капилляры особого синусного типа (от слово «синус» — «пазуха»). В синусах между внутренними выстилающими их клетками находятся поры, через которые ткань органа кроветворения непосредственно контактирует с кровяным руслом. Такое строение обеспечивает перемещение клеток крови из этих органов в кровоток и поступление к ним из крови различных веществ.
Итак, костный мозг у человека является главным местом образования клеток крови. В нем содержится основная масса стволовых кроветворных клеток и осуществляется образование эритроцитов, гранулоцитов, моноцитов, лимфоцитов, мегакариоцитов.
Костный мозг участвует в разрушении эритроцитов, в синтезе гемоглобина, служит местом накопления резервных жировых соединений. В связи с наличием в нем, а также в селезенке и лимфатических узлах большого количества мононуклеаркых фагоцитов все эти органы принимают участие в фагоцитозе.
Селезенка — один из наиболее сложноустроенных органов кроветворения у человека. Она принимает участие в лимфоцитопоэзе, разрушении эритроцитов, лейкоцитов и тромбоцитов, в накоплении железа и синтезе иммуноглобулинов. В ее функцию входит и депонирование (задержка в резерве) крови.
Селезенка, лимфатические узлы и вилочковая железа являются составными частями лимфатической системы, ответственной за выработку иммунитета.
Иммунитет — это невосприимчивость организма к инфекционным и неинфекционкым агентам и веществам, обладающим чужеродными антигенными свойствами. В эту систему входят также лимфатические образования, расположенные по ходу желудочно-кишечного тракта.
Центральным органом в системе формирования иммунитета является вилочковая железа. Установлено влияние вилочковой железы на образование Т-лимфоцитов, дифференцирующихся из костномозговых предшественников и участвующих в клеточных реакциях иммунитета. В-лимфоциты, осуществляющие гуморальные реакции иммунитета, образуются в костном мозге.
Деятельность кроветворных органов регулирует нервная система и гуморальные факторы стимулирующего и подавляющего действия.
Кроветворная система в детском возрасте обладает большими восстановительными возможностями, но вместе с тем она легко ранима. При некоторых заболеваниях возможно появление очагов кроветворения вне костного мозга, например, в печени, селезенке и лимфатических узлах.
Кроветворение у новорожденного
Кровь новорожденных детей имеет свои особенности, которые заключаются в следующем.
Удельный вес и вязкость крови у детей выше, чем у взрослых.
Количество гемоглобина и эритроцитов у них повышено.
У новорожденного на 1 кг массы тела приходится около 140 мл крови.
Количество гемоглобина при рождении колеблется от 170 до 240 г/л. После очень кратковременного нарастания в течение первых часов жизни это количество снижается и к концу первой недели падает до 140 г/л.
После рождения ребенок имеет 80% фетального (плодного] гемоглобина [HbF] и лишь 20% гемоглобина взрослых [HbA]. Постепенно в течение первых 3 месяцев жизни происходит замена фетального гемоглобина гемоглобином взрослых.
Число эритроцитов у здоровых новорожденных детей в первый день жизни колеблется от 4,5x1012/л до 7x1012/л (в среднем около 6x1012/л].
Вслед за некоторым повышением количества эритроцитов в первые 6—12 часов жизни новорожденного происходит систе-матическое снижение количества эритроцитов. К концу первого месяца жизни количество эритроцитов составляет у ребенка 4,5x1012/л.
Но кроветворение ребенка отличается не только количеством эритроцитов. У новорожденных детей средний диаметр эритроцитов значительно больше, чем у взрослого человека (7,2 мкм), и достигает 7,9—8,2 мкм. Такие эритроциты обозначают термином «макроциты» (большие эритроциты). Макроцитоз (увеличение размеров) эритроцитов — возрастная особенность новорожденных.
Присутствие в крови эритроцитов разного диаметра носит название акизоцитоза (anisos — «неравный»). Такие эритроциты содержат неодинаковое количество гемоглобина, поэтому у новорожденных легко выявляется разная окраска эритроцитов — полихроматофилия.
В крови у доношенных новорожденных детей встречается значительное количество предшественников эритроцитов — ретикулоцитов. Ретикулоцитами называют эритроциты, в которых с помощью специальной окраски выявляется сеточка [ретикулум] — следы, остатки цитоплазмы содержащих ядро клеток — предшественников эритроцитов.
В первче дни жизни ребенка количество ретикулоцитов превышает 4%. Затем их количество резко понижается, а к концу первого месяца жизни достигает обычно 0,6—0,8%, что считается нормой.
В первые часы жизни в крови новорожденных можно выявить значительное количество содержащих ядро предшественников эритроцитов — нормоцитов, однако их число быстро снижается, и уже к концу первой недели они больше не обнаруживаются.
Цветовой показатель эритроцитов у новорожденных в течение первой недели жизни чаще бывает выше единицы (до 1,3), что связано с тем, что макроциты [эритроциты большого диаметра] содержат гемоглобина больше, чем обычные эритроциты.
Наличие большого числа эритроцитов, повышенное количество гемоглобина, увеличение предшественников зрелых эритроцитов [ретикулоцитов и нормоцитов] указывает на усиление гемопоэза у новорожденных.
Это объясняется тем, что внутриутробный период развития связан у плода с меньшим поступлением кислорода, чем у новорожденного, в организм которого кислород проникает не через плаценту матери, а с помощью легочного дыхания.
Относительная гипоксемия (сниженное количество кислорода в крови) плода компенсируется увеличенным количеством гемоглобина и эритроцитов.
Скорость оседания эритроцитов у новорожденных несколько замедленна (СОЭ — 2-3 мм/ч), имеются эритроциты с повышенной и пониженной осмотической стойкостью.
Число лейкоцитов при рождении достигает 10x109/л — 30x109/л. В первые часы жизни их число несколько увеличивается, а затем снижается. У детей первого года жизни число лейкоцитов 11x109/л считается нормальным.
В течение первых же дней жизни у ребенка значительно изменяется лейкоцитарная формула — процентное соотношение отдельных элементов белых клеток крови.
Число нейтрофилов, достигающее при рождении 66% общего количества белых клеток крови, начинает быстро снижаться, а число лимфоцитов [при рождении около 15—30%], наоборот, быстро нарастает.
Около 5—6-го дня жизни кривые нейтрофилов и лимфоцитов, отражающие процентное соотношение этих клеток в периферической крови, перекрещиваются [первый перекрест], и к концу месяца число нейтрофилов снижается до 30—25%, а число лимфоцитов повышается до 55—60%.
В период новорожденности всегда отмечается умеренный сдвиг формулы нейтрофилов влево до миелоцитов и метамиелоцитов, количество эозинофилов колеблется от 0,5 до 8%, базофилы часто отсутствуют, количество моноцитов достигает 8—14%.
Изменения в лейкоцитарной формуле у новорожденных аналогичны таковым в анализе крови беременной женщины в последние дни перед рождением ребенка. Некоторые ученые считают, что эти изменения обусловлены гормональными изменениями, происходящими в организме матери накануне родов.
Проникновение гормонов через плаценту стимулирует гранулоцитопоэз у плода и новорожденного. После родов эти влияния прекращаются. В связи с этим лейкоцитарная формула в первые дни жизни ребенка изменяется не по дням, а по часам.
Количество тромбоцитов в крови новорожденных колеблется от 140x109/л до 400x109/л. Кровяные пластинки бывают неодинаковой величины и формы.
Таким образом, особенности крови новорожденных детей характеризуются высоким уровнем гемоглобина, быстрой сменой фетального гемоглобина гемоглобином взрослых, большим количеством эритроцитов, лейкоцитов и тромбоцитов и высоким цветным показателем.
Интересно отметить, что если количество форменных элементов в крови взрослых мужчин и женщин имеет отличия, то пол ребенка заметно не отражается на количественной и качественной картине всех форменных элементов крови.
Кроветворение в грудном возраста
Начавшееся после рождения снижение уровня гемоглобина продолжается в течение первых месяцев жизни у всех даже совершенно здоровых, правильно вскармливаемых детей, живущих в хороших условиях.
Уровень гемоглобина у детей грудного возраста может понижаться до 120—110 г/л и оставаться на этих цифрах до конца первого года жизни. Количество эритроцитов снижается до 4x1012/л—3,5x1012/л. Цветовой показатель становится меньше единицы [0,8—0,75].
Указанные данные для грудного ребенка являются совершенно нормальным явлением. Однако врачам-педиатрам известно, что самые разнообразные причины — неправильное питание, недостаточное пребывание на свежем воздухе, негигиенические условия жизни, заболевания — могут усиливать этот физиологический процесс, вызывая развитие патологического малокровия.
В грудном возрасте количество гемоглобина и эритроцитов подвержено большим индивидуальным колебаниям.
После 2—3 месяцев жизни у ребенка в крови исчезают анизоцитоз и полихроматофилия эритроцитов.
К 3 месяцам непосредственные предшественники эритроцитов — ретикулоциты редко превышают нормальный уровень [0,6—0,8%]. СОЭ [скорость оседания эритроцитсв] у грудных детей держится на уровне 3—5 мм/ч.
Количество лейкоцитов в крови в среднем составляет 10х109/л—11х109/л. Среди лейкоцитов преобладают лимфоциты, отмечается небольшой сдвиг нейтрофилов влево до палочкоядерных форм, умеренно выражен моноцитоз.
В грудном возрасте количества кровяных пластинок [тромбоцитов] стабилизируется на уровне 200х109/л—300x109/л.
Для морфологического состава крови детей первого года жизни характерны значительные индивидуальные колебания, что зависит от чувствительности всей системы кроветворения каждого отдельного ребенка к воздействию внешних и внутренних факторов.
Кровь ребенка в последующие периоды жизни отличается уже большим постоянством и к моменту полового созревания приобретает сходство с кровью взрослых.
Кроветворение в дошкольном возрасте и старше.
У детей старше одного года постепенно нарастает количество гемоглобина (до 130—150 г/л) и эритроцитов (до 4,5x1012/л—5x1012/л).
Количество предшественников эритроцитов — ретикулоцитов не превышает 0,6—0,8%. Цветовой показатель составляет 0,85—1,0. СОЭ в этом возрасте постепенно достигает 5—10 мм/ч.
Количество лейкоцитов у старших детей имеет тенденцию уменьшаться до 9x109/л—6x109/л. В лейкоци-тарной формуле постепенно становится больше нейтрофилов и соответственно меньше лимфоцитов.
Второй перекрест кривых процентного содержания нейтрофилов и лимфоцитов происходит в 5—7-летнем возрасте ребенка, а затем количество нейтрофилов у детей все больше и больше превалирует над лимфоцитами, пока не достигнет цифр, характерных для взрослых.
Если перед первым перекрестком абсолютное числа нейтрофилов почти в 2 раза превосходит абсолютное число лимфоцитов, то до второго перекреста, например в возрасте одного года, абсолютное число нейтрофилов в 2 раза меньше абсолютного числа лимфоцитов, но после второго перекреста, в 5—7-летнем возраста, количество нейтрофилов продолжает расти (а лимфоцитов соответственно снижаться) и, наконец, к 14—15 годам жизни ребенка количество нейтрофилов вновь в 2 раза превышает количество лимфоцитов.
С возрастом несколько уменьшается количество моноцитов, исчезают плазматические клетки. Количество тромбоцитов у детей независимо от возраста соответствует норме взрослых и составляет 200x109/л—З00x109/л.
Необходимо иметь в виду, что у детей и в возрасте старше одного года показатели крови подвержены довольно шиооким индивидуальным колебаниям, однако эти колебания тем шире, чем моложе ребенок.
У детей стершего школьного возраста и подростков показатели крови аналогичны таковым у взрослых людей.
ЧТО НАДО ЗНАТЬ О СХЕМЕ КРОВЕТВОРЕНИЯ
В периферической крови плода человека на ранних этапах основными клетками являются эритробласты, количество которых на 4—8-й неделе достигает 100x109/л, а затем интенсивно снижается до 5x109/л на 28-й неделе.
Число гранулоцитов увеличивается в эти же сроки с 0,050x109/л до 10,0x109/п. Первичные лимфоциты в тимусе появляются уже на 9—10-й неделе, моноциты еще раньше — с 5-й недели.
Количество отдельных клеток у эмбриона и плода колеблется в довольно широких пределах, а общая закономерность состоит в том, что содержащие ядро примитивные эритробласты постепенно сменяются нормальными эритробластами. Образование гранулоцитов по мере взросления плода неуклонно нарастает.
Включившись в гемопоэз с 13—14-й недели, костный мозг к моменту рождения ребенка становится основным органом кроветворения у человека.
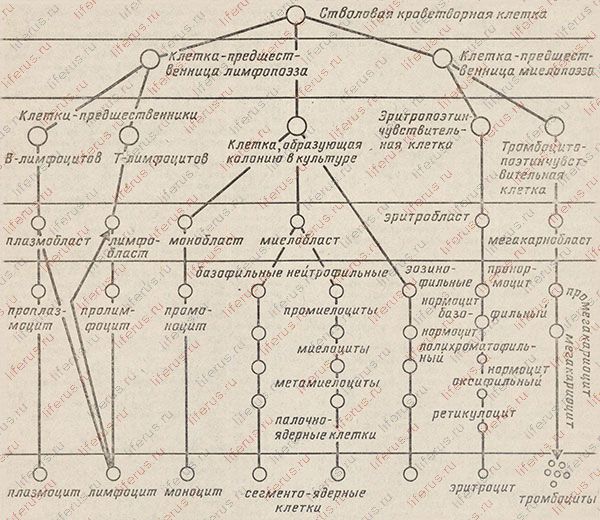
Процесс кроветворения можно представить в виде схемы, напоминающей ствол дерева, от которого расходятся ветви. Зрелые, дифференцированные клетки можно представить себе как завершающие отдельную ветвь листья, а может быть, как цветы или плоды.
Для удобства восприятия от простого к более сложному в схеме кроветворения ствол дерева перевернут на 180°, поэтому не ствол, а отдельные ветви обращены к земле.
Первой ступенью, или исходными клетками, форменных элементов крови являются так называемые стволовые клетки. Морфологически они сходны с большими лимфоцитами. Эти клетки способны и к самостоятельному существованию, и к дифференцировке по всем отдельным росткам кроветворения. Такая исходная потенциальная многогранность клеток по их возможностям обозначается термином «полипотентность».
Отдельная стволовая клетка обладает очень высокой способностью к самостоятельному существованию или самоподдержанию. Число проделываемых ею делений (митозов) может достичь 100.
Из всех стволовых клеток в состоянии деления находится одна из каждых пяти клеток, а остальные четыре пребывают в покое, ожидая своего часа, если таковой наступит. Они могут вступить в действие, когда организму нужно бороться с последствиями больших кровотечений.
Следующая, вторая ступень развития форменных элементов крови представлена двумя типами клеток: клеткой — предшественницей лимфопоэза и клеткой — предшественницей элементов костного мозга: гранулоцитов, моноцитов, эритроцитов, тромбоцитов.
Экспериментальных доказательств существования клеток-предшественниц пока не получено, однако анализ опухолевых трансформаций, наблюдавшихся в клетках при некоторых заболеваниях крови и кроветворных органов (в частности, при лейкозах), привел авторов схемы к выводу, что такие клетки должны существовать. На схеме кроветворения эти предполагаемые клетки обозначены пунктирами.
Третья ступень, или третий класс клеток, — поэтин-чувствительные клетки. Морфологически их трудно отличить от стволовых клеток, так как они выглядят как большие и средние лимфоциты. Каждая из них является родоначальницей строго определенного ростка, или ветви кроветворения.
В связи с этим третий класс клеток называют еще унипотентными клетками-предшественницами. Их деятельность зависит от гуморальной регуляции, то есть координация физиологических и биохимических процессов внутри этих клеток осуществляется через жидкие среды (кровь, лимфу и тканевую жидкость) с помощью специальных растворенных в них веществ, которые носят название «поэтины».
Поскольку именно на уровне указанных клеток реализуется количественная регуляция кроветворения, среди поэтинчувствительных клеток доля делящихся, размножающихся клеток достигает 60—80 и даже 100%.
Из клеток третьего класса на рисунке можно видеть предшественников В-лимфоцитов, Т-лимфоцитов, общего предшественника гранулоцитов [нейтрофилов и базофилов] и моноцитов, предшественника эритроцитов [эритропоэтинчувствительную клетку], предшественника тромбоцитов [тромбоцитопоэтинчувствительную клетку].
В схеме кроветворения есть и исключения из общего правила. Так, установлено, что эозинофилы имеют собственную клетку-предшественницу иную, чем общая клетка — предшественница гранулоцитов и моноцитов.
Четвертый класс клеток — это так называемые властные клеточные элементы, открывающие уже совершенно самостоятельные, обособленные созревающие клеточные пулы, клеточные ряды.
Для В-лимфоцитов исходной клеткой созревающего клеточного пула является плазмобласт, для Т-лимфоцитов — лимфобласт, для моноцитов — монобласт, для гранулоцитов — миелобласт, для эритроцитов — эритробласт, для тромбоцитов — мегакариобласт.
Ростковые [бластные] клетки почти всех рядов [пулов] по морфологическим признакам [за исключением метакариобласта] бывает очень трудно различать. Для их идентификации в настоящее время предложены многочисленные окраски.
По сочетанию скрещивающихся ферментов и интенсивности окраски бластные клетки относят к тому или иному ростку кроветворения.
СХЕМА КРОВЕТВОРЕНИЯ
Пятый класс клеток — созревающие клеточные элементы. Они не только претерпевают деления, но и дифференцируются — первоначально одинаковые клетки превращаются в специализированные клетки тканей и органов.
С процессе дифференцировки клетки проделывают неодинаковое количество митозов [делений], поэтому из одной клетки-предшестзенницы может образоваться разное количество клеток. Каждому ростку свойственно свое число митозов.
Шестой класс клеток — это зрелые, дифференцированные клетки, которые током крови вымываются из костного мозга в циркулирующую кровь.
Для оценки клеточного состава костного мозга предложены нормативные показатели, отражающие процентное соотношение клеток паренхимы костного мозга (его кроветворной части). Эти показатели приведены в таблице.
Нормативные показатели клеточных элементов костного мозга
| Клеточные элементы костного мозга | В процентах | |
|---|---|---|
| Среднее значение | Пределы нормальных колебаний | |
| Ретикулярные клетки |
0,9 |
0,1—1,6 |
| Бласты |
0,6 |
0,1—1,1 |
| Миелобласты |
1,0 |
0,2—1,7 |
| Нейтрофильные: | ||
| промиелоциты |
2,5 |
1,0—4,1 |
| миелоциты |
9,6 |
7,0—12,2 |
| метамиелоциты |
11,5 |
8,0—15,0 |
| палочкоядерные |
18,2 |
12,8—23,7 |
| сегментоядерные |
18,6 |
13,1—24,1 |
| Все нейтрофильные элементы |
60,8 |
52,7—68,9 |
Как и любой другой орган, костный мозг состоит из паренхимы и стромы. Абсолютное большинство клеток в костном мозге представлено клетками паренхимы [кроветворной ткани] и их производными — зрелыми дифференцированными клетками крови.
Клетки стромы костного мозга носят обобщающее название «механоциты». Среди механоцитов различают ретикулярные клетки — недифференцированные клетки стромы, фибробласты и фиброциты, остеобласты и остеоциты.
ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ
Железодефицитная анемия — это малокровие, обусловленное дефицитом в организме железа. Возникновение термина «анемия» ]бескровие] связано с развитием болезненного состояния организма в результате той или иной степени кровопотери.
В настоящее время установлено, что анемия развивается не только под влиянием кровопотери, но и вследствие нарушения образования гемоглобина и эритроцитов, а также из-за повышенного их разрушения.
О происхождении болезни
В 85—90% случаев железодефицитные анемии у детей отмечаются в еозрасте до 3 лет. Причины этих анемий определяются нарушением поступления, распределения и использования железа в организме ребенка.
В течение первых 6 месяцев внутриутробной жизни плод практически не получает железа из организма матери. Накопление железа у плода начинается лишь в последние 3 месяца до нормальных родов. К моменту рождения нормальный доношенный ребенок имеет запас железа в организме в количестве 250—300 мг.
У новорожденных и у детей раннего возраста железо в организме распределяется следующим образом: 80% — в эритроцитах, 1% — в костном мозге, плазме, макрофагально-гистиоцитарной системе, ферментах, 10 — 12% — в печени и селезенке, 7—9% — в мышцах.
У детей среднего и старшего возраста и у взрослых 65—70% железа сосредоточено в эритроцитах, 1% — в костном мозге, плазме, макрофагально-гистиоцитарной системе, ферментах, 10—15% — в печени и селезенке, 20—22% — в мышцах.
Различают геминное [функционирующее железо эритроцитов, эритробластов, миоглобина, ферментов], транспортное [в плазме крови] и негеминное [в мышцах и органах] железо.
Таким образом, приведенные данные показывают, что доля депонированного железа у новорожденного и ребенка раннего возраста почти в 2 раза меньше, чем у взрослого.
Недоношенность на 1—2 месяца может привести к сокращению запасов железа в 1,5—2 раза и более по сравнению с нормой.
В норме свыше 50% кругооборота железа в организме совершается по замкнутому циклу, связанному с образованием и разрушением эритроцитов, и лишь 10% кругооборота железа происходит за счет восполнения сравнительно небольших потерь этого элемента продуктами питания.
Железо расходуется на рост ногтей и волос, пигментацию последних, участие в иммунологических процессах, выделяется при десквамации кожи, с потом, при менструациях, скрытых и явных кровотечениях, выводится из организма с желчью, мочой, калом, расходуется при инфекциях.
Большой дополнительный расход железа происходит при беременности, кормлении ребенка грудью, а у детей — при быстром росте, в период полового созревания.
Новорожденный ребенок очень быстро растет, что предъявляет к его костному мозгу повышенные требования, так как увеличивающаяся масса тела требует соответственно увеличения массы крови.
Запасы железа в организме постепенно истощаются, а поступление жепеза с грудным молоком матери становится явно недостаточным. В 1 л женского молока содержится всего 0,7 мг жепеза, из которого усваивается всего пишь 13—22 мкг%. Минимальная потребность ребенка в железе составляет 0,5 мг в сутки.
Таким образом, чтобы удовлетворить суточную потребность в этом элементе с учетом железа, всасываемого с материнским молоком, ребенок должен выпить его 25 л в сутки!
Итак, ребенок раннего возраста развивается при отрицательном балансе железа — потребность в нем превышает поступление в 25 раз!
При искусственном и смешанном вскармливании детей дефицит железа еще больше, так как содержание усваиваемого железа в коровьем молоке в 2—3 раза меньше, чем в женском.
В том случае, когда все запасы железа с пищевыми продуктами по тем или иным причинам не покрывают его отрицательного баланса в организме, последний до определенного времени покрывается из депо.
Когда и запасы депо оказываются исчерпанными, отрицательный баланс железа в организме из скрытого становится явным — развивается железодефицитная гипохромная анемия.
У доношенных детей это чаще происходит к 4—5-му месяцу жизни, у недоношенных — еще раньше, на 2—3-м месяце. Развившуюся железодефицитную анемию вылечить только с помощью продуктов питания, богатых железом, невозможно.
Более того, обеспечение ребенка продуктами питания, богатыми железом, не всегда предотвращает его недостаток в организме. Не всякое железо всасывается в кишечнике.
В частности, содержащаяся в продуктах питания окись железа всасывается очень плохо, в то время как закись железа хорошо. Вот почему для улучшения снабжения организма ребенка железом необходимо, чтобы окисное железо превратилось в закисное.
Такому превращению способствует витамин С, а также медь и нормальная кишечная флора.
Переедание, употребление преимущественно растительной пищи, однообразное молочное питание, изменение бактериальной флоры кишечника [диебактериоз] под влиянием длительного применения антибиотиков тормозят процесс восстановления железа, т. е. переход его из окисного в закисное.
Кроме того, следует учитывать, что такие вещества, как фосфаты, кальцинаты и др., соединяясь с железом, образуют нерастворимые соли; это также препятствует усвоению железа.
Всасывание железа происходит в двенадцатиперстной кишке и прилегающих к ней участках тонкого кишечника. Если ребенок страдает органическим расстройством деятельности желудка и кишечника, то всасывание железа значительно ухудшается.
В диагностике железодефицитных анемий имеют значение некоторые анамнестические сведения, в частности, дефицит железа у матери в период беременности (многоплодная беременность, преждевременные роды и т. д.), недоношенность, травмы ребенка во время родов, резкая бледность и вялость новорожденного, кровотечения у него.
Большое значение в возникновении железодефицитных анемий в последующие возрастные периоды имеют инфекционные заболевания, искусственное, смешанное и одностороннее вскармливание (питание), например молочное и мучное, рахит, глистная инвазия, резкое снижение кислотности желудочного сока, интенсивный рост, бурное половое созревание, ранние м обильные менструации у девочек, обильные кровопотери после травм.
Клиническая картина
Клиническими проявлениями железодефицитной анемии являются потеря аппетита, задержка физического развития, вялость, неустойчивое настроение ребенка плаксивость.
Обращает на себя внимание прогрессирующая бледность слизистых оболочек рта и кожи. Кожа приобретает восковидный оттенок. Ушные раковины становятся особенно бледными и прозрачными.
В период полового созревания некоторые подростки имеют типичный «хлоротичный» вид: резкую бледность кожи с зеленоватым оттенком (отсюда и название «хлороз», шершавость кожи, хрупкость ногтей, ломкость волос [волосы секутся, выпадают].
Независимо от возраста отмечается гипотония мышц. Обычные для ребенка подвижные игры быстро вызывают физическое утомление, апатию, иногда сонливость.
Со стороны сердечно-сосудистой системы отмечаются такие симптомы, как учащение пульса, незначительное расширение границ сердца разномерно во все стороны, у некоторых больных появляется нежный «анемический» систолический шум над областью сердца.
В патологический процесс вовлекаются и органы пищеварения. У детей с жалезодефицитными анемиями снижается аппетит, иногда дети совсем отказываются от пищи.
В ряде случаев аппетит извращается и дети начинают есть явно несъедобные вещи, например, мел, землю и т. д.
Наблюдаются спастические явления в пищеводе, кишечнике, которые выражаются в болевых ощущениях за грудиной, в животе. При тяжелой анемии появляются диспепсические расстройства — запор, понос. У некоторых детей увеличивается печень и селезенка.
Нарушается деятельность центральной нервной системы. Могут беспокоить головная боль, шум и звон в ушах, наблюдаются головокружения, обмороки, теряется интерес к окружающему, к учебе, выражен негативизм, утрачивается способность к сосредоточению, снижается успеваемость в школе.
У ребенка падает эмоциональный тонус и хорошее настроение, он становится плаксивым, раздражительным, капризным. Маленькие дети отстают в психомоторном развитии, у них легче развивается гипотрофия.
Дети склонны к более частым ринитам, у них развивается атрофия сосочков языка [«полированный язык»], легко образуется кариес зубов в результате нарушений обмена в эмали.
Возможности диагностики
Самые характерные симптомы определяются при исследовании крови. Выявляется снижение содержания гемоглобина. Минимальный уровень гемоглобина у детей в возрасте до 3 месяцев принято считать равным 126 г/л, от 3 месяцев до 5 лет — 110 г/л, старше 5 лет — 120 г/л.
Железодефицитная анемия диагностируется и считается легкой при снижении уровня гемоглобина до 90 г/л, среднетяжелой — до 70 г/л, тяжелой — менее 70 г/л, катастрофической — менее 30 г/л.
Уменьшение эритроцитов в периферической крови бывает только у 20% дегей с тяжелой анемией. Эритроцитопения совсем не обязательный признак для железодефицитнсй анемии у детей. Во все возрастные периоды количество эритроцитов на нижней границе нормы соответствует 4,2x1012/л.
Среди нормальных эритроцитов [нормоцитов] обнаруживаются эритроциты с рядом морфологических особенностей: отмечается анизоцитоз — появление эритроцитов различного диаметра пойкилоцитоз — выявление эритроцитов измененной формы [вытянутые, колбообразные, грушевидные, заостренные, веретенообразные и т. д.], микроцитоз — обнаружение эритроцитов уменьшенного диаметра. Количество ретикулоцитов не изменено.
Цветовой показатель рассчитывается по формуле Е. А. Кост (1975):
А x 0.3 : В = цветовой показатель, где
А — содержание гемоглобина в грамм-процентах;
В — первые две цифры числа эритроцитов.
В норме цветовой показатель колеблется от 0,85 до 1,05. При железодефииитной анемии цветовой показатель снижается ниже 0,85.
К наиболее достоверным признакам железодефицитной анемии относятся уменьшение сывороточного железа [в норме сывороточное железо составляет 13,5—30,0 мкХмоль/л], повышение общей железосвязывающей способности сыворотки крови [в норме 45—72 мкХмоль/л].
В костном мозге лейкоэритробластическое отношение не нарушается [в норме 4:1], в красном [эритронормобластическом] ростке уменьшается число оксифильных нормоцитов и несколько увеличивается число полихроматофильных нормоцитов.
Возможности лечения
Любое заболевание отягощает течение анемии, затрудняет ее лечение. Ребенка, больного анемией, надо тщательно изолировать от больных с другими заболеваниями, не допускать ни перегревания, ни охлаждения.
Питание больного ребенка максимально разнообразят, с тем чтобы он получал все необходимые пищевые вещества и микроэлементы.
Для детей старше 5 месяцев в диету включают овощное пюое, в состав которого входят белокочанная капуста, моркозь, свекла, шпинат, репа, цветная капуста и др., а старше 7 месяцев — мясной фарш и 1—2 раза в неделю отварную печенку или печеночный паштет.
Обязательно следует давать яичный желток. Помимо названных выше продуктов, детям дают свежие фрукты и ягодные соки.
К продуктам, богатым железом, медью, кобальтом, никелем и марганцем, относятся язык, печень, мясо, рыба, горох, фасоль, картофель, свекла, редис, капуста, орехи, черная смородина, сливы, груши, яблоки, смесь сушеных фруктов.
Кобальтом и фолиевой кислотой богаты творог, яичный желток, печень, дрожжи.
Одностороннее питание детей, в частности преимущественно молочное, крупяное и мучное, оказывает неблагоприятное влияние на результаты лечения.
Лечение железодефицитных анемий включает устранение кровотечений [острых, хронических, скрытых и явных], назначение препаратов железа и витаминов.
Если у ребенка глисты, проводят дегельминтизацию.
Препараты железа целесообразно назначать в промежутках между приемами пищи до 3—4 раз в день, запивать водой.
Непосредственно до и после приемов препаратов железа не рекомендуется давать детям чай, молоко, жирные и некоторые мучные пгодукты (сдобное тесто, печенье), поскольку они способствуют образованию нерастворимых соединений железа, которые плохо всасываются в кишечнике. Это же стносится к кофе и неразбавленным фруктовым сокам.
Чтобы препараты железа лучше усваивались и меньше раздражали слизистую желудочно-кишечного тракта, их рекомендуют принимать через 1 час после еды.
Курсовая доза железа рассчитывается по формулам. Приведем формулу Е. Н. Мосягиной (1969):
Fe — (курс в мг) = (16 г% — Hв г%) : 100 x 3,4 X 75 X (вес больного в кг) х 1,3,
где:
16 г — идеальное содержание железа в крови;
3,4 — количество мг железа в 1,0 г гемоглобина (Нв);
75 — количество крови в мл на 1 кг веса ребенка [в среднем];
1,3 — добавочный коэффициент, исходящий из того, что в норме количество депонированного железа составляет 30% от железа эритроцитов.
Лучший лечебный эффект оказывают препараты двухвалентного закисного железа так как они легко всасываются в кишечнике. Детям раннего возраста назначают жидкие препараты железа, старшего возраста — в таблетках и порошках.
Из жидких препаратов используют сироп алоэ с железом [в 1 мл 20 мг элементарного железа], орферон жидкий [Югославия].
Детям старше одного года назначают любые препараты закисного двухвалентного железа, которые они хорошо переносят: железа закисного сульфат [200 мг элементарного железа в 1.0 г препарата], железа лактат [200 мг элементарного железа в 1,0 г препарата], гемостимулин [50 мг элементарного железа в 1 таблетке], ферроплекс (40 мг элементарного железа в 1 таблетке], феррокаль [40 мг элементарного железа в 1 таблетке], ферроцерон [40 мг элементарного железа в 1 таблетке] и другие препараты.
При двухвалентной форме лекарственного железа в среднем суточная доза рекомендуется из расчета 5 мг/кг [4—6 мг/кг]: детям до 3 лет — 60—90 мг/сут, детям 3—6 лет — 100—200 мг/сут. детям старше 7 лет — до 300 мг/сут.
В случае непереносимости (тошнота, рвота, понос, запор, боли е животе) или побочном токсическом действии препаратов железа [оно более выражено у препаратов, содержащих трехвалентнее железо] лекарство нужно отменить или сделать перерыз в лечении.
Если препараты железа вызывают диспепсические расстройства, то их дозу уменьшают наполовину [временно!], а после еды назначают панкреатин (по 0,15—0,2 г x З раза в день).
Лечение витамином В12 показана лишь к концу лечения, когда депо организма насыщены железом и цветной показатель приближается к единице, но количество эритроцитов еще не достигло возрастной нормы, в этом случае целесообразно произвести 2—3 инъекции витамина В12 по 50—100 мкг в сутки через день для стимуляции эритропоэза.
По достижении нормальных показателей содержания гемоглобина лечение препаратами железа не прекращают, а продолжают еще 6—8 недель для создания депо железа в печени, селезенке, мышцах.
При лечении тяжелых железодефицитных анемий иногда прибегают к парентеральному [внутримышечному и внутривенному] введению препаратов. Показаниями являются невозможность принимать препараты железа внутрь в связи е непереносимостью, мальабсорбцией, язвенной болезнью и пр.
Применяют феррумлек [для внутримышечного введения 1 ампула содержит 100 мг железа в 2 мл, для внутривенного введения 1 ампула содержит 100 мг жепеза а 5 мл), фербитол (для внутримышечного введения, болезнен, 1 флакон содержит 100 мг железа в 2 мл), жектофер (для внутримышечного введения 1 ампула содержит 130 мг железа в 2 мл).
Ежедневная максимальная доза препарата для внутри мышечного введения в наружный квадрант ягодицы составляет детям до 1 года с массой тела до 5 кг — 0,5 мл; с массой тела 5—10 кг — 1 мл; детям после 1 года — 2 мл; детям старшего возраста — 3—4 мл.
Парентеральные препараты могут вызывать аллергические реакции вплоть до шока.
Лечение этими препаратами возможно только в стационаре, по строгим показаниям, обязательно в присутствии и под наблюдением врача.
Острые и тяжелые постгеморрагические анемии, особенно при отсутствии адаптации к ним больного, развитии гипоксии необходимо купировать с помощью эритроцитной массы, которую вводят медленно струйно из расчета 10 мл/кг массы тела ребенка первого года жизни и в разовой дозе 120—250 мл капельно детям старшего возраста.
Трансфузия 100 мл эритроцитной массы эквивалентна введению 120 мг полностью утилизируемого железа.
Из витаминных и витаминизированных препаратов можно рекомендовать следующие.
Витамин С (аскорбиновая кислота) — участвует в обмене железа (способствует его всасыванию в кишечнике, включению в гем и сохранению железа в геме двухвалентным).
Разовая доза 0,05—0,15 x 2—3 раза а день после еды. Выпускается а таблетках по 0,025; 0,05 и 0,1.
Сироп из плодов шиповника — готовится из сока плодов шиповника и экстракта ягод калины, клюквы, рябины и др. В 1 мл содержит 4 мг аскорбиновой кислоты.
Назначается по ½—1 чайной, десертной, столовой ложке в зависимости от возраста 2—3 раза а день. Выпускается в бутылочках по 260—270 мл или в баночках по 200 мл.
Витаминизированный сироп из плодов шиповника содержит в 1 мл препарата 30 мг витамина С и 15 мг витамина Р. Выпускается в баночках по 200—250 мл. Назначается по ½—1 чайной ложке 1—3 раза в день.
Прогноз при железодефицитной анемии у детей благоприятный. Заболевание может прогрессировать лишь при отсутствия лечения. Недостаточное по объему лечение может перезести манифестный дефицит железа в латентный, скрытый. Возможны рецидивы заболевания.
Профилактика железодефицитной анемии наиболее эффективна при содружественной работе терапевта, акушера-гинеколога и педиатра. По рекомендации ВОЗ целесообразен прием препаратов железа в профилактической дозе, составляющей 1/3 лечебной, женщиной при повторной беременности, при наличии у нее в анамнезе анемии, обильных кровотечений.
Группу риска по железодефицитной анемии составляют дети, родившиеся с большой массой тела, врожденной гипотрофией, от многоплодной беременности, недоношенные, а также от матерей, страдавших латентным дефицитом железа или анемией.
В эту же группу входят дети с аллергическими поражениями кожи и слизистых оболочек [экссудативный диатез], с респираторными и кишечными заболеваниями, глистными инвазиями.
У перечисленных детей легко возникает патентный дефицит железа и железодефицитная анемия. В связи с этим указанная группа детей подлежит диспансерному наблюдению в течение 2 лет с регулярным анализом кроаи 1 раз в 3 месяца [наиболее информативен анализ после заболеваний, кровопотери и других анемизирующих факторов].
При малейших признаках дефицита железа, а тем более наличии железодефицитной анемии необходимо назначать комплексное противоанемическое лечение.
ВНИМАНИЮ ЧИТАТЕЛЕЙ!
В следующем выпуске В. Е. Поляков расскажет о гемофилии и болезни Верльгофа [у детей] Подробнее >>>
По материалам журнала "Твоё здоровье" 11.1990 г.